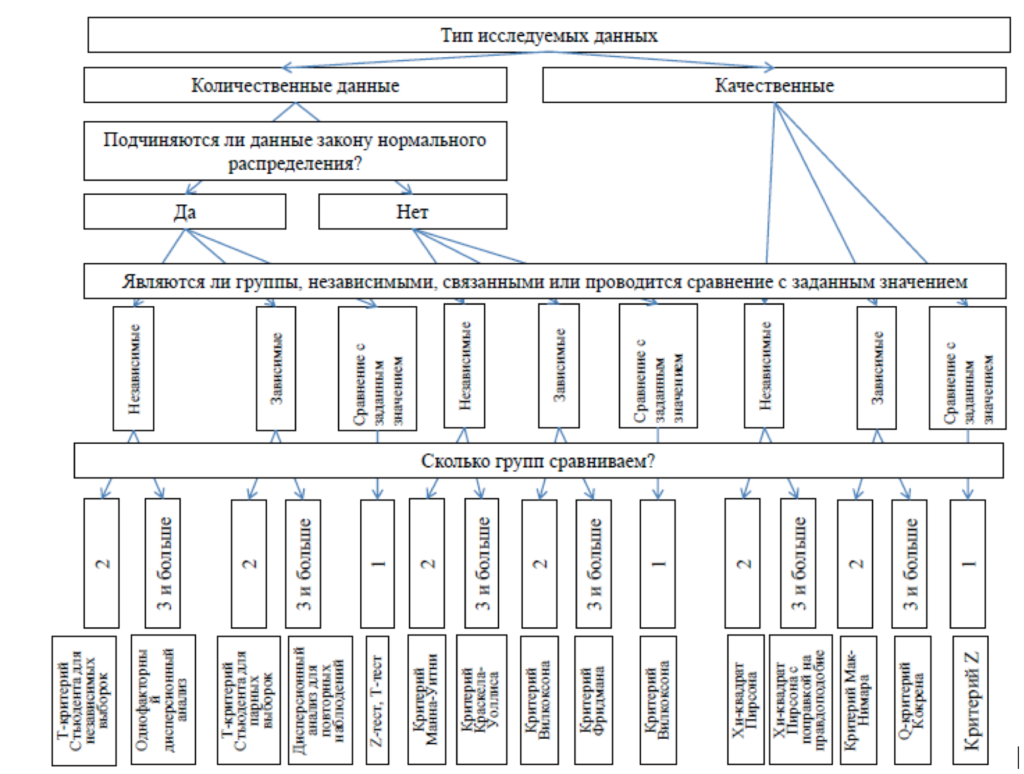
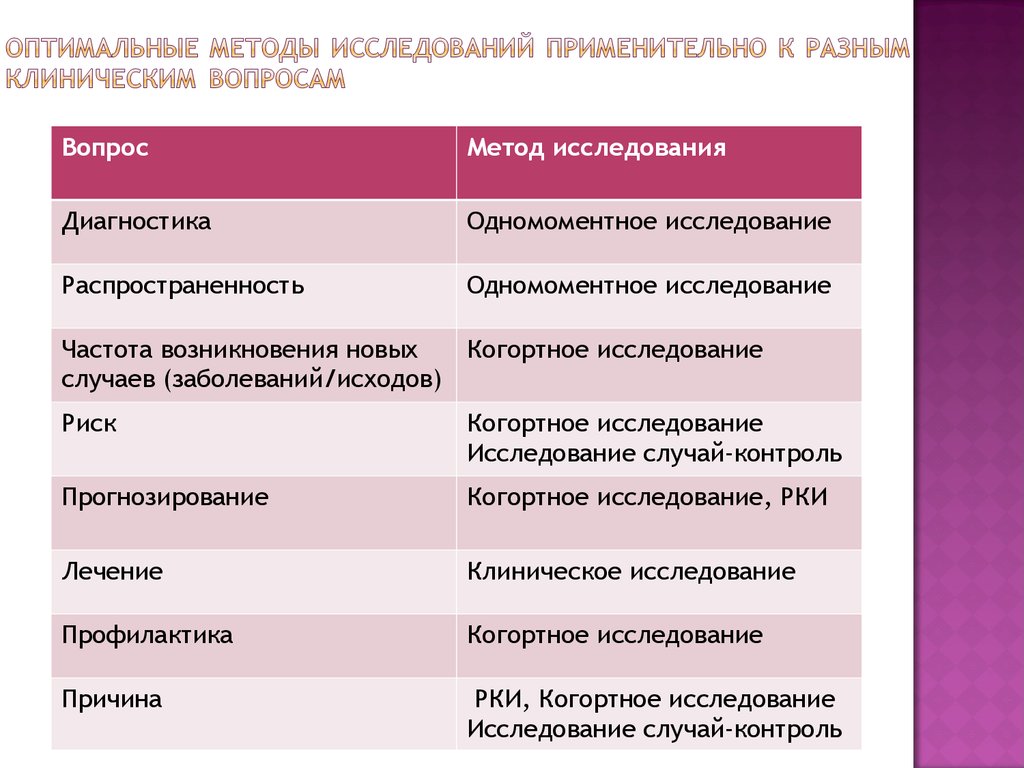
Study design guidelines
Пирогова: клинических исследований лекарственных препаратов, медицинской техники и медицинских изделий. Режим работы:. Гибридная костно-хрящевая трансплантация без стоимости расходного материала. Клиника регулярно принимает участие в международных регистрах , таких как:.






Посмотреть результаты. Как вы оцениваете доступность оказания медицинской помощи с использованием ЭКО? Удовлетворены ли вы оказанием медицинской помощи с использованием ЭКО?
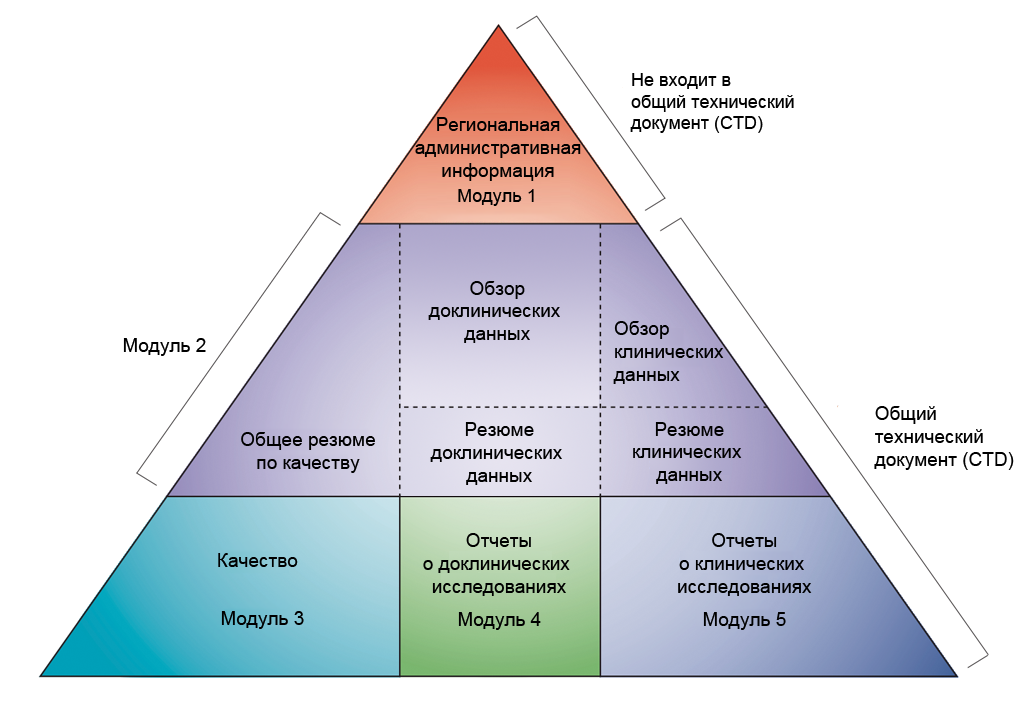




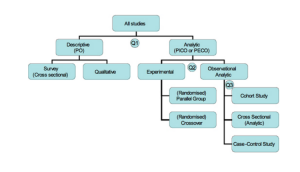

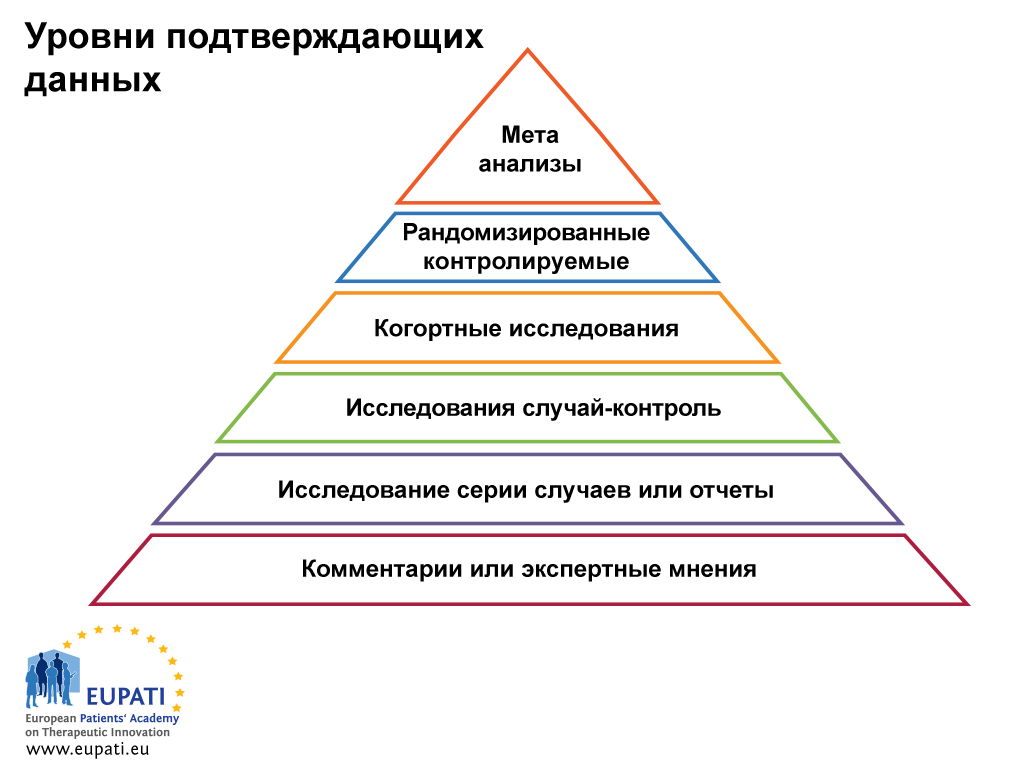
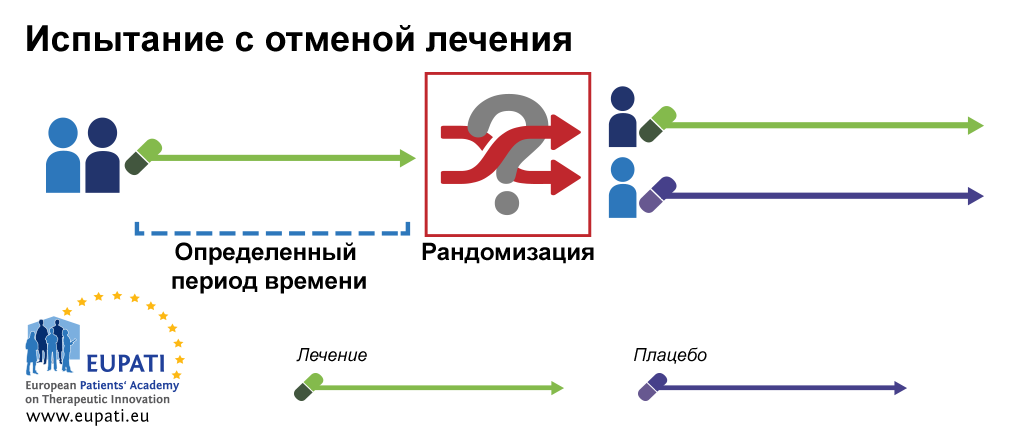
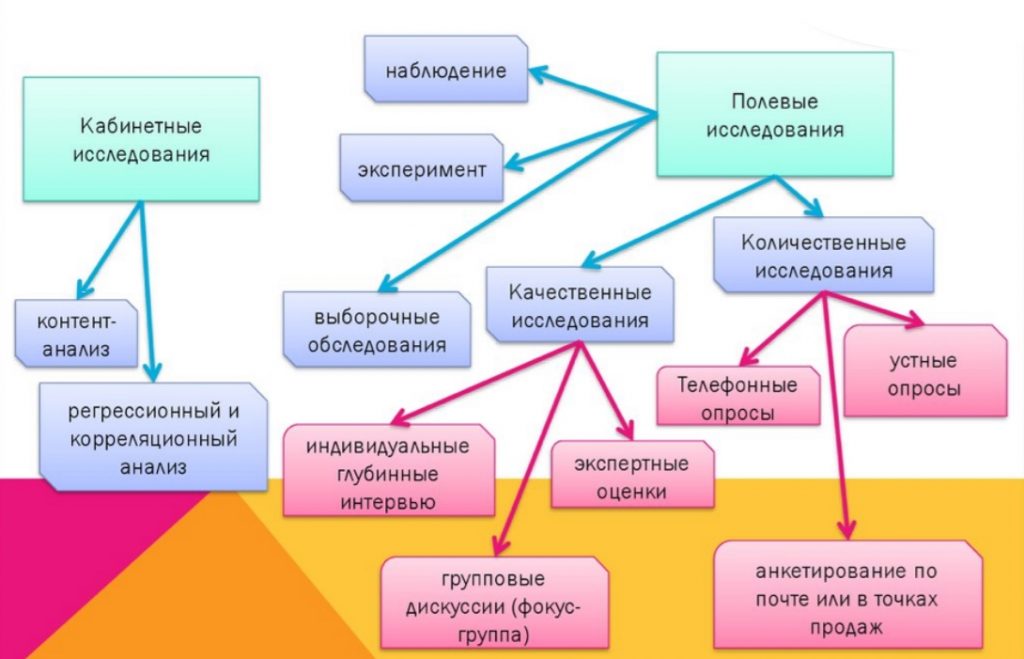
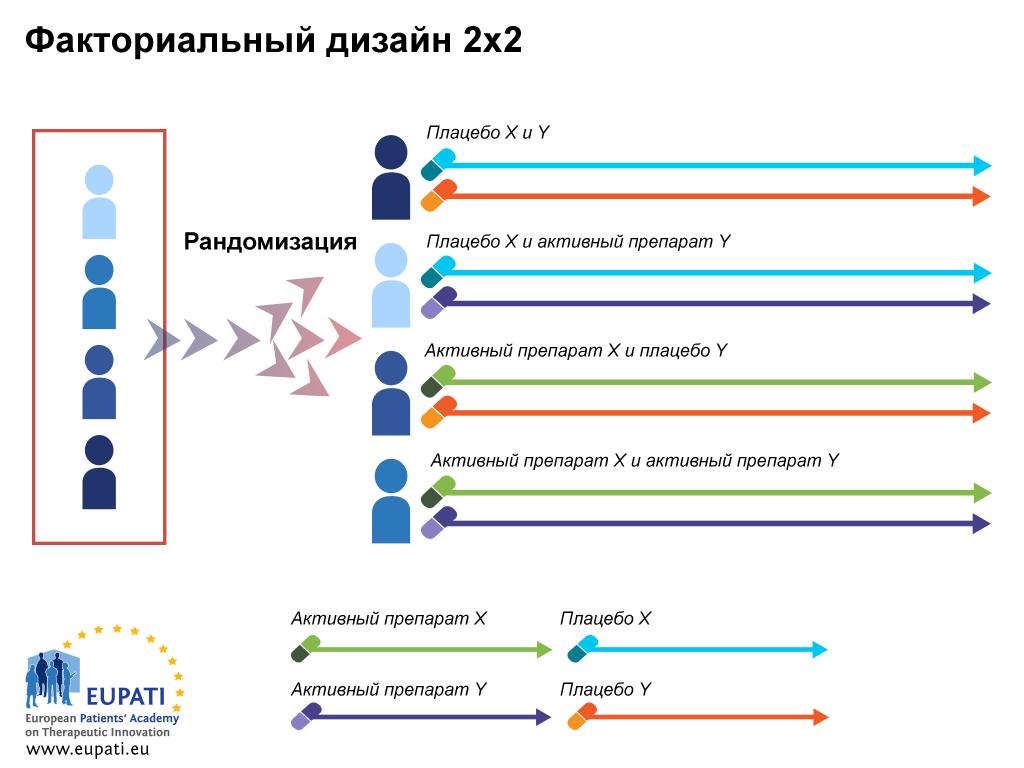
Клинические исследования могут также изучать эффективность и безопасность новых инвазивных в том числе хирургических и неинвазивных методов лечения и диагностики. Клинические исследования во всём мире являются неотъемлемым этапом разработки препаратов, который предшествует его регистрации и широкому медицинскому применению. В ходе клинических исследований новый препарат изучается для получения данных о его эффективности и безопасности. На основании этих данных уполномоченный орган здравоохранения принимает решение о регистрации препарата или отказе в регистрации. Препарат, не прошедший клинических исследований, не может быть зарегистрирован и выведен на рынок [ 1 ] [ 2 ] [ 3 ].
.jpg?1728891911)